1.ダニエル電池
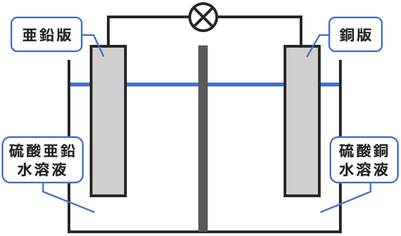
ダニエル電池の構造
ダニエル電池で用いる電極は亜鉛板と銅板です。
電解質水溶液としては硫酸亜鉛水溶液と硫酸銅水溶液の2種類を、素焼き板(セロハンの場合もあります)で仕切りながら使われています。↓
硫酸亜鉛と硫酸銅は次のように電離します。
ZnSO4 → Zn²⁺ + SO₄²⁻
CuSO₄ → Cu²⁺ + SO₄²⁻
よって・・・
容器の左側には亜鉛イオンZn²⁺と硫酸イオンSO₄²⁻が、
容器の右側には銅イオンCu²⁺と硫酸イオンSO₄²⁻が存在します。↓

ダニエル電池のしくみ
①イオン化傾向
亜鉛と銅では、亜鉛の方がイオン化傾向が大きいです。
つまり
亜鉛・・・(陽)イオンになりたい
銅・・・・(陽)イオンになりたくない
という違いが生じます。
②亜鉛版での変化
イオン化傾向の大きな亜鉛がイオンとなります。
具体的には
亜鉛原子Znが、電子を失って亜鉛イオンZn²⁺になる
という変化が起こります。↓

式で書くと Zn → Zn²⁺ + 2e⁻
※「e⁻」は電子のこと
見た目では、亜鉛版はどんどん溶け出し、質量が減少します。
③銅版での変化
亜鉛原子が手放した電子は、導線を通って銅板にたどり着きます。
放っておくと銅板にはどんどん電子がたまります。
この電子を受け取るのが、液中の銅イオンCu²⁺です。
銅はイオン化傾向が小さい金属です。
つまり原子にもどりたいということです。
具体的には
銅イオンCu²⁺が、電子を得て銅原子Cuとなる
という変化が起こります。↓

式で書くと Cu²⁺ + 2e⁻ → Cu
見た目では、銅が析出し、銅板の質量が増加します。
素焼き板の役割
①左側(硫酸亜鉛水溶液)の濃度の変化
左側では、亜鉛イオンがどんどん生じます。
↓
最初と比べて亜鉛イオンの濃度が高くなります。
↓
左側は、全体として+にかたよることになります。
(+の電気の方が多くなる)
①右側(硫酸銅水溶液)の濃度の変化
右側では、銅イオンがどんどんなくなります。(銅原子へと変化する)
↓
最初と比べて銅イオンの濃度が低くなります。
↓
右側は、全体として-にかたよることになります。
(-の電気の方が多くなる)

③素焼き板による調整
電子は-の電気を持つので、+と引き合い、-としりぞけ合います。
そのため電子が左側から右側に移動がしづらくなり、徐々に電池の電圧(起電力)が低下します。
素焼き板はこれを防ぐための役割を持ちます。
素焼き板にはイオンが通過できるほどの小さな穴が開いています。
左側は+にかたよっているので、右側から硫酸イオンSO₄²⁻が移動してきます。
右側は-にかたよっているので、左側から亜鉛イオンZn²⁺が移動してきます。↓

こうなることで左右ともに電気的に中性の状態が保たれます。
つまり起電力の低下を防ぐことができるのです。
ダニエル電池の注意点
①硫酸亜鉛水溶液の濃度は低くしておく
反応が進むと亜鉛イオンが液中に溶けだします。
そのため、できるだけ亜鉛イオンの居場所をつくるために、硫酸亜鉛水溶液の濃度を低くしておきます。
(亜鉛イオンを溶け出しやすくする)
そうすると電池が長持ちします。
②硫酸銅水溶液の濃度は高くしておく
反応が進むと液中の銅イオンが減少していきます。(銅原子に変わる)
そのため、はじめの銅イオンが少ないとすぐに反応が終わってしまいます。
できるだけ銅イオンがたくさんある状態にするために、硫酸銅水溶液の濃度を高くしておきます。
(銅原子を析出しやすくする)
そうすると電池が長持ちします。
「ダニエル電池」
■亜鉛版では・・・
→亜鉛原子が電子を失って亜鉛イオンとなる。
■銅板では・・・
→銅イオンが電子を得て銅原子となる。
次回は「アンモニアの利用」です!
詳しく「札幌自学塾」を知りたい方は、ホームページを参照してください! こちらをクリック>>
無料体験・申し込みは、「お問い合わせ欄」からメールしてください! こちらをクリック>>

