1.質量比を考える
原子1個あたりには質量があり、もちろん現実に測定されています。
同じ種類の原子は同じ質量を持ち、その種類ごとに質量は異なります。
たとえば炭素原子の質量は、1.9944235 × 10⁻²³ (g) です。(とっても軽い)
こんな数字を使っていては計算がやりにくいので、原子1個の質量比を利用します。
例1)水素の燃焼
「水素が燃焼して水になる」という反応について見てみましょう。
水素原子・酸素原子の1個あたりの質量比は
水素原子:酸素原子=1:16
です。
これを利用すれば、どのような比で物質が反応するかもわかります。
まず水素の燃焼を化学反応式で書くと
2H₂ + O₂ → 2H₂O
となります。
これをモデル図に書きかえましょう。↓

ここで先ほどの比「水素原子:酸素原子=1:16」を利用して、
水素原子1個を1g・酸素原子1個を16g
と仮に考えます。
これをモデル図に書き込みましょう。↓
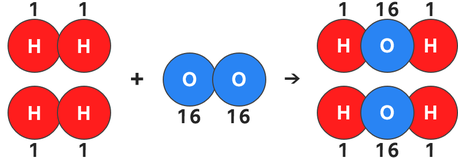
この質量を物質ごとに足してみます。
たとえば水素分子H₂は
H₂・・・H + H = 1g + 1g = 2g
と表せます。
ほかの物質も同様に計算すると↓のようになります。

よって
2H₂:O₂:2H₂O = 4:32:36
の比で反応することになります。
このとき、質量保存の法則も成り立っていることを確認しておきましょう。
▼質量保存の法則
化学変化の前後で質量の総和は変わらない。
例2)酸化銅の水素による還元
今度は「酸化銅を水素によって還元する」反応について見ていきましょう。
まずこの反応を化学反応式で書くと
CuO + H₂ → Cu + H₂O
となります。
ここで質量比ですが、それぞれの原子の1個あたりの質量比は
銅原子:酸素原子:炭素原子:水素原子 = 64:16:12:1
です。
これをモデル図に書きかえましょう。↓

次に先ほどの比を利用して
銅原子1個を64g・酸素原子1個を16g・炭素原子1個を12g・水素原子1個を1g
と仮に考えます。
これをモデル図に書き込みましょう。↓

この質量を物質ごとに足してみます。↓

よって
CuO:H₂:Cu:H₂O = 80:2:64:18
の比で反応することになります。
(質量保存の法則が成り立っていることも確認しておきましょう。)
このように比が求まれば計算ができるようになります。
たとえば
「28gの酸化銅を還元するのに必要な水素は?」
と聞かれても、
求める水素をx(g)として
80:2 = 28:x
x = 0.7
となり0.7gと求めることができます。
原子1個の質量比を利用すれば、化学変化における反応の質量比も分かる。
①化学反応式を書く。
②モデル図になおす。
③モデル1つ1つに原子1個の質量を書き込む。
→反応する物質の質量を求めていく。
次回は「気体の発生」です!
詳しく「札幌自学塾」を知りたい方は、ホームページを参照してください! こちらをクリック>>
無料体験・申し込みは、「お問い合わせ欄」からメールしてください! こちらをクリック>>

