1.水溶液
▼水溶液
溶質・・・・溶けている物質(食塩など)
溶媒・・・・溶かすための溶液(多くの場合が水)
溶質・・・・できあがった液体(食塩水など)
水溶液・・・溶媒が水である溶液
▼水溶液の性質
・透明である。(無色透明だけではなく、有色透明のものもある)
・どこでも濃さは同じ。
水溶液の例
〇塩酸・・・・・・・溶質が塩化水素。刺激臭がする。
〇アンモニア水・・・溶質がアンモニア。刺激臭がする。
〇硫化銅水溶液・・・青色をしている。
〇塩化銅水溶液・・・青色をしている。
〇石灰水・・・・・・溶質が水酸化カルシウム。二酸化炭素を通すと白くにごる。
2.濃度
▼質量パーセント濃度
単に濃度ということも多い。
以下のように求められる。
質量パーセント濃度(%)=溶質(g)÷ 水溶液全体(g)× 100
例題
(1)水60gに食塩を40g溶かしたときの質量パーセント濃度は何%か。
(2)濃度20%の食塩水200gに溶けている食塩は何gか。
(3)濃度30%の食塩水150gに水300gを加えたとき、濃度は何%になるか。
(4)濃度20%の食塩水50gと濃度20%食塩水250gを混ぜると濃度は何%になるか。
(5)濃度25%の食塩水640gの濃度を40%にするには何gの水を蒸発させればいいか。
ただしどの場合でも食塩の溶け残りは発生しないものとする。
【解答】
(1)水60gに食塩を40g溶かしたときの質量パーセント濃度は何%か。

濃度の公式を使います。
しかし
40g÷60g×100
としてはいけません。
割る数は水溶液全体であることに気をつけましょう。
正しくは
40g÷(40g+60g)×100=40%
となります。
よって正解は40%です。
(2)濃度20%の食塩水200gに溶けている食塩は何gか。

こちらは濃度の公式を変形させて溶質を求めましょう。
200g×0.2=40g
よって正解は40gです。
(3)濃度30%の食塩水150gに水300gを加えたとき、濃度は何%になるか。
水溶液を混ぜる、蒸発させるといった操作をしている場合は、溶質(ここでは食塩)の量に注目して式をつくっていきます。
まず濃度30%の食塩水150gに溶けている食塩の量を考えます。

濃度の公式から
150g×0.3=45g
よって食塩は45gであることがわかりました。
次に水300gを加えています。

これで食塩水は450gになりました。
したがって濃度は
45g÷450g×100=10%
よって正解は10%です。
(4)濃度20%の食塩水50gと濃度20%食塩水250gを混ぜると濃度は何%になるか。
同じく食塩の量に注目です。
50gの食塩水、250gの食塩水に溶けている食塩の量をそれぞれ計算します。

50g×0.2=10g・・・①
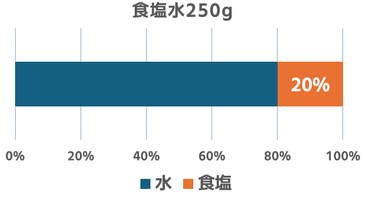
250g×0.2=50g・・・②
2つの食塩水を混ぜ合わせると、
食塩の量は
①+②=10g+50g=60g
食塩水の量は
50g+250g=300g

したがって濃度は
60g÷300g×100=20%
よって正解は20%となります。
(2つの食塩水はどちらも20%です。同じ濃度の水溶液は混ぜ合わせても濃度は変わりません。なのですぐに20%と答えることもできます。)
(5)濃度25%の食塩水640gの濃度を40%にするには何gの水を蒸発させればいいか。
同様に、まずは食塩の量を求めます。

640g×0.25=160g
ここで「蒸発させる水の量」をx(g)としてみましょう。

このxを使って溶質を求める式を立ててみます。
(640-x)×0.4=160g
これを解いてx=240g。
したがって正解は240gです。
・水溶液を混ぜたり、一部を蒸発させたりする問題は溶質の量に注目して式を立てよう。
次回は「溶解度」です!
詳しく「札幌自学塾」を知りたい方は、ホームページを参照してください! こちらをクリック>>
無料体験・申し込みは、「お問い合わせ欄」からメールしてください! こちらをクリック>>

